Азотная кислота — это сильная неорганическая гидроксид-кислота, которая востребована во всех сферах промышленности. Её используют в качестве реактива для получения взрывчатых веществ, аммонийных удобрений, лекарственных средств. Раствор азотной кислоты необходим для изготовления пластмасс, проявления фотографий, создания красящих составов, фунгицидов, промывки труб и теплообменников.
Что такое азотная кислота, формула, видыКонцентрированная азотная кислота представляет собой вещество, состоящее из водорода и кислотного остатка. Химическая формула – HNO3. Чистая азотная кислота в естественных условиях не встречается, однако её находят в смеси с другими веществами (селитра). Первые способы синтеза раствора азотной кислоты возникли в 8 веке. В дальнейшем методика модифицировалась и усложнялась.
Различают два вида азотной кислоты, которые характеризуются разной степенью выраженности химических характеристик и зависят от насыщенности раствора кислотой:
концентрированная азотная кислота – проявляет свойства сильнейшего окислителя; разбавленная азотная кислота – реагирует как типичная сильная кислота.Концентрированная азотная кислота, как правило, имеет коричневатый цвет, т.к. в ней присутствует оксид азота. На рынке азотная кислота существует в двух разновидностях: марка «А» пригодна для обработки электротехники, радиотехники, металлов, а также для выпуска препаратов и пластмасс. Марка «Б» наиболее распространена как растворитель, в процессах нитрования, в гальванике.
Физические свойства, внешний вид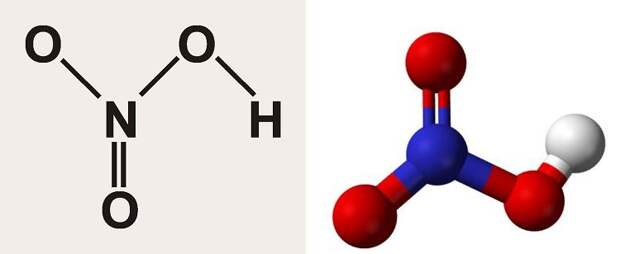
Структурная формула и молекула азотной кислоты
При нормальных условиях азотная кислота — это жидкость без цвета, которая дымится на воздухе.
Эффект дымления вызван тем, что она постепенно испаряется и формирует с влагой из воздуха мелкие капли тумана. Соединение неустойчиво по отношению к перепаду температур, свету, повышенной влажности. Под действием яркого освещения постепенно разлагается. Температура плавления отрицательна, достигает -41,59 °С. Раствор азотной кислоты закипает при +82,6 °С. Термолиз начинается при повышении температурного режима до +260 °С.Свойство азотной кислоты хорошо растворяться в воде обуславливает азеотропную смесь – смешение двух жидкостей, при кипячении не изменяющий своего состава. Вещество гигроскопично, способно образовывать кристаллогидраты с соответствующими формулами:
HNO3 ∙ H2O; HNO3 ∙ 3H2O.Концентрированная азотная кислота может существовать и в твёрдой форме: в виде мелких ромбических беловатых либо бесцветных кристаллов.
Химические свойства, реакцииАзотная кислота вступает в характерные для кислот реакции из-за определённых свойств. Так, с натриевым гидроксидом кислота азотная даёт нитрат и воду:
HNO3 + NaOH → NaNO3 + H2O
Реакция кислоты азотной и окисления металлов демонтирует уравнение азотной кислоты с натрием:
HNO3 + Na → 8NaNO3 + N2O↑ + 5H2O
В реакции кислоты азотной с аммиаком происходит формирование аммонийной селитры:
HNO3 + NH3 → NH4NO3
Уравнение азотной кислоты показывает, как при попадании прямых солнечных лучей и подогревании запускается разложение:
4HNO3 → 4NO2↑ + O2↑ + 2H2O
В ходе взаимодействия выделяется неприятный на запах бурый газ. Вступает раствор азотной кислоты в реакции с основными оксидами, которые протекают по схожему со щелочами механизму:
2HNO3 + Na2O → 2NaNO3 + H2O
Разбавленный раствор азотной кислоты проявляет себя по-другому в реакциях кислоты азотной с металлами, в результате выделяется молекулярный азот:
12HNO3 + Na → 10NaNO3 + N2↑ + 6H2O
С гидроксидом кислота азотная приводит к формированию азотнокислого алюминия:
3HNO3 + Al(OH)3 → Al(NO3)2 + 3H2O
Раствор концентрированной азотной кислоты, в которой содержится оксид азота, окисляет сернистый газ:
HNO3 + SO2↑ → H2SO4 + 2NO↑
Уравнение азотной кислоты в реакции с сульфитом натрия в качестве продукта демонстрирует выделение сульфата и диоксид азота:
HNO3 + Na2SO3 → Na2SO4 + 2NO2↑ + H2O
Производство и получение, уравнениеВ лабораторных условиях получение азотной кислоты ведётся путём диспропорционирования в водной среде:
2NO2 + H2O → HNO3 + HNO2
Также в лаборатории синтез азотной кислоты производят путём внесения пероксида водорода к азотистой кислоте:
HNO2 + H2O2 → HNO3 + H2O
В промышленности азотную кислоту добывают в процессе Оствальда, который включает несколько этапов. Они описываются экзотермическими реакциями (с выделением тепла) между нитрозными оксидами, которые завершаются выделением азотной кислоты:
Окисление аммиака: 4NH3 + 5O2 → 4NO↑ + 6H2O Оксид азота (II) окисляется до оксида азота (IV): 2NO + O2 → 2NO2↑ Оксид азота (IV) поглощает вода при обилии O2 4NO2 + O2 + 2H2O → 4HNO3 Применение азотной кислотыПрименение азотной кислоты распространено в различных областях. Наибольшее потребление всей производимой азотной кислоты приходится на сферу химии. Посредством реагента здесь добываются различные органические производные: сложные эфиры, ароматические амины. Вещество распространено как исходный продукт для применения средств сельского хозяйства для предпосевной обработки почвы и избавления от грибковых заболеваний. Как очиститель азотная кислота востребована в ювелирном деле, в пищевой отрасли.
Применение азотной кислоты в фармацевтике и садоводствеАзотная кислота важна для фармацевтической промышленности, поскольку с её помощью получают нитроглицерин путём смешивания глицерина со смесью азотной и серной кислоты. Нитроглицерин —лекарственный препарат, необходимый для расслабления гладкой мускулатуры кровеносных сосудов. Этот вазодилататор назначают пациентам со стенокардией, он купирует острый приступ, уменьшая боль и вероятность возникновения инфаркта миокарда.
Актуально применение кислоты для создания азотных удобрений. Их вносят в почву при пониженном содержании азота. Растения азотном голодании желтеют, теряют тургор, страдает плодоношение и цветение. Внесение удобрения позволяет улучшить вкусовые качества плодов и повысить декоративность культур. Данная кислота является основой для противогрибковых средств, направленных на борьбу с серой и чёрной гнилью, фитофторозом, паршой.
Применение азотной кислоты в лакокрасочной промышленности и других сферахАзотная кислота эффективна для создания органических красителей. Её применяют для получения взрывчатки, тротила, отравляющего вещества. Важна её дымящая функция и токсичность для человека, что используется при проектировании боевого оружия. Едкость азотной кислоты выгодно применима в травлении форм для станковой графики.
Азотная кислота – это реактив для получения многих соединений. Так, она требуется для выработки нитроалканов – качественных растворителей, топлива реактивных двигателей. Применение кислоты также распространяется на выпуск сырья для бездымного пороха – нитроцеллюлозы.
В фотографии сегодня азотная кислота используется реже, поскольку на смену плёнкам пришли цифровые изображения и из-за её агрессивных свойств. Ранее раствор азотной кислоты применялся для повышения кислотности во время тонировки.
С помощью азотной кислоты осуществляют проверку содержания золота в сплаве. Если при капании на поверхность выделяется газ, это означает, что изделие ниже 583 пробы. Чем обильнее образование пузырьков, тем ниже концентрация золота.
Опасность и меры предосторожностиАзотная кислота крайне токсична, относится к 3 классу опасности. Смертельно ядовита при вдыхании, повреждает слизистую дыхательных путей. При контакте с кожей провоцирует пожелтение кожного покрова и возникновение язв. При работе с реагентом следует соблюдать меры безопасности, надевать защитные перчатки, респиратор и очки.
Перевозка, хранениеХранят азотную кислоту в тёмной непрозрачной таре в прохладном вместе вдали от света. Транспортировку осуществляют в герметично закрытых полиэтиленовыми пробками хромированных либо алюминиевых ёмкостях.
Где купить, цена и производителиКак концентрированную азотную кислоту, так и разбавленную можно приобрести в специализированных магазинах химических реактивов. Цена 1 литра – от 750 рублей. Оптом она продаётся заводами-производителями по стоимости от 45 руб/кг при минимальной закупке – 40 кг. Основные производители азотной кислоты:
компания «Полимер»; КИТАЙХИМПРОМ; «Урал-ОЦМ»; НПК «ОборонМетХим». ЗаключениеАзотная кислота – это ценное вещество, применяемая во всех областях деятельности человека. В основном её применение распространяется на цели промышленной органики и неорганики, апробации золотых сплавов, поставки взрывчатки, лекарств, фунгицидов. Раствор азотной кислоты и её пары вредны для здоровья, при эксплуатации соединения нужно работать в защитной одежде. Бывает концентрированная азотная кислота и разбавленная.
Читайте также:
Оксид азота: свойства, применение, реакции Пищевая закись азота: вред, описание, свойства, применение Нитрат меди: свойства, реакции и применение Угольная кислота: описание, свойства и реакции, применение
Свежие комментарии