Нитрат серебра – это неорганическое высокореактивное вещество, обладающее сильными окислительными свойствами. Активно используется в медицине как дезинфицирующее, кровеостанавливающее, для уничтожения бородавок. Азотнокислое серебро необходимо в фотографии, гальванотехнике, а также в аналитической химии.
Оно довольно опасно и токсично, поэтому при обращении с ним следует соблюдать меры предосторожности, в некоторых областях было заменено более безопасными реагентами. Что такое нитрат серебра, формулаНитрат серебра представляет собой среднюю серебряную соль азотной кислоты. В составе серебро – металл переходной группы, проявляющий небольшую электроотрицательность, переменную степень окисления: от +1 до +3, а также кислотный остаток. Химическая формула:
AgNO3
Впервые нитрат серебра был получен в 13 веке Альбертом фон Больштедтом, это синтетическое соединение, не встречающееся в природе. Впервые его применили в 1620-х годах голландские физиологи Гельмонт и Сильвий для обеззараживания глаз новорождённых, чьи матери страдали от гонореи. Тогда же ему было дано название лунный, адский или ляписный камень (в переводе с латинского «ляпис» – камень, луной называли серебро) за его выжигающую способность.
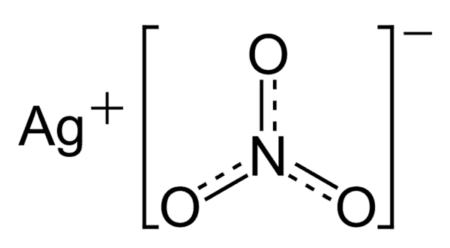
Структурная формула нитрата серебра
Физические свойства, внешний видНитрат серебра – это мелкодисперсный порошок пластинчатых либо ромбических кристаллов без цвета и запаха, с острым горько-солёным неприятным вкусом. Плотность высокая, сниженная гигроскопичность. Растворимость ляписа в воде хорошая, с повышением температурного режима возрастает.
Хуже растворяется в спиртах (этанол, метанол), плохо в других полярных растворителях: пиридине, ацетоне.Ляпис плавится при температуре 209 °С, при подогревании до 300 °С начинается термическое разложение. Несмотря на гидрофильность, не образует кристаллогидратов. Устойчив к воздействию агрессивных факторов окружающей среды. Растворы дают кислое значение водородного показателя, pH менее 7.
Химические свойства, реакцииОсобые химические свойства обуславливают то, что нитрат серебра реагирует с более слабыми металлами. Например, с железом, при этом серебро выпадает в осадок серебристого цвета:
AgNO3 + Fe → Fe(NO3)2 + 2Ag↓
Характерно реагирование серебра нитрата с щелочами. С едким натром в числе продуктов выделяется нерастворимый оксид:
AgNO3 + NaOH → AgO2↓ + NaNO3 + H2O
В спиртовой среде при отрицательной температуре (-50 °С) взаимодействие с каустическим поташем приводит к выделению аморфной гидроокиси серебра:
AgNO3 + KOH → AgOH↓ + KNO3
Ионные реакции серебра ляписа протекают по механизму обмена. С хлороводородом он даёт белый хлорид:
AgNO3 + HCl → AgCl↓ + HNO3
C цианистым калием реакция серебра нитрата идёт двумя путями:
AgNO3 + KCN → AgCN↓ + KNO3
В первом случае происходит отделение цианида серебра и растворимого нитрата калия. При втором варианте реакция серебра нитратного идёт с образованием комплекса дицианоаргентата:
AgNO3 + KCN → K[Ag(CN)2] + KNO3
Комплексообразованием характеризуется реакция серебра нитрата с концентрированными парами аммиака, образуется нитрат диамминсеребра:
AgNO3 + NH2 → [Ag(NO3)2]NO3
Термолиз протекает до металлического серебра, бурого газа и молекулярного кислорода:
2AgNO3 → 2Ag↓ + 2NO2↑ + O2↑
При пропускании через раствор нитрата электрического тока наблюдается электролиз:
4AgNO3 + H2O → 4Ag↓ + 4HNO3 + O2↑
В реакции с сероводородом происходит формирование черных сульфидов:
2AgNO3 + H2S → Ag2S↓ + 2HNO3
Производство и получениеИ в лабораторных, и в промышленных условиях основой для синтеза ляписа является растворение серебра в азотной кислоте:
Ag + 2HNO3 → AgNO3 + NO2 + H2O
В лаборатории для этого выбирают чистый метал, в промышленности – серебросодержащее сырьё. Технология включает несколько этапов:
В реакторе, снабжённом мешалкой, осуществляют растворение при атмосферном давлении и периодическом перемешивании при 35 °С. В раствор подают пероксид водорода, смешивают в течение 30 минут. Полученную массу фильтруют, в ней содержатся примеси хлораргирита, который отправляют на повторную переработку для извлечения аргентума. Маточный раствор переходит в кристаллизатор, в котором выделяются кристаллы. Затем происходит перекристаллизация для увеличения чистоты продукта. Порошок фильтруется и подаётся в вакуумную сушку, где из него извлекают ненужную жидкость.На масштабных производствах в целях безопасности стараются применять менее концентрированную кислоту.
ПрименениеОсновная сфера использования ляписного карандаша – медицина. Он обладает комплексом полезных фармацевтических свойств, ярко выраженной антимикробной активностью. В химии это ценный предшественник других соединений серебра, которые получают путём неорганического и органического синтеза. Нитрат серебра способен окрашивать микропрепараты и оставлять тёмные трудно смываемые следы на коже, что пригодилось для изготовления избирательных чернил.
Применение в медицинеНитрат серебра – это действующее вещество антибактериальных препаратов, использующихся для обеззараживания свежих ран и язв. В древности им пользовались для закапывания в царапины и укусы от бешеных животных, чтобы предотвратить развитие смертельной болезни. Сегодня известно, что ляпис демонстрирует несколько фармакологических действий:
прижигающее – запаивает края повреждений, не допуская попадания внутрь бактерий; противовоспалительное – снимает воспаление, покраснение и зуд, уменьшает кровоточивость; антисептическое – убивает патогенные микроорганизмы; вяжущее – создаёт на поверхности кожи тонкую защитную плёнку; бактерицидное – не только замедляет размножение бактериальных патогенов, но и губительно действует на их клетки; противогерпетическое – направлен на борьбу с бородавками.Механизм действия ляписного карандаша заключается в связи сульфидных группировок в мембране возбудителей, что вызывает изменение конформации (формы) белка, вызывает его денатурацию. В клеточной стенке создаются отверстия, несовместимые с жизнью для болезнетворной микрофлоры. Ляпис блокирует работу их ферментных систем, замедляя развитие их колоний.
Применение в химической промышленности и других областяхНитрат серебра – востребованный и недорогой реагент, имеющий ряд преимуществ для индустрии синтетических веществ. Он устойчив к повышенной влажности и действию ультрафиолетового излучения, смешивается с различными растворителями. Этим обусловлено его использование для добычи сульфитов, карбонатов, йодидов, в качестве индикатора загрязнений питьевой воды.
В фотографии раствор ляписа – проявитель для плёнок, компонент фотоэмульсий. В производстве зеркал он служит источником ионов серебра, а в приготовлении несмываемых чернил – основный красящий компонент.
Токсичность и опасностьНитрат серебра – это агрессивный окислитель. Нанесение ляписного карандаша в небольших концентрациях оправданно, однако следует внимательно следить за состоянием при терапии препаратами на его основе. Соединение относится ко 2 классу опасности (высокоопасные вещества). Длительное воздействие на кожу, слизистые оболочки приводит к возникновению глубоких ожогов.
При повышении в плазме крови концентрации серебра появляются симптомы аргирии – изменения цвета кожных покровов на серо-синий. Отравление при случайном проглатывании включает дисфункцию желудочно-кишечного тракта, тошноту, рвоту. Смертельная доза – 10 г. Вдыхание пыли раздражает дыхательные пути.
Инструкция по применению ПоказанияНитрат серебра назначается для коррекции следующих состояний:
гонококковая инфекция грудничков; эрозии, изъязвления, трещины; бородавки; носовые кровотечения. ПротивопоказанияГлавное противопоказание – индивидуальная непереносимость средства и повышенная чувствительность к нему. Это выражается в резкой аллергии, образовании отёка, сильной боли. Возникает редко. Чтобы избежать неприятных последствий, необходимо консультироваться перед использованием.
Способ применения и дозыЛекарство наносят на поражённый участок тонким слоем, не рекомендуется дотрагиваться до здоровых зон раз в три дня. Продолжительность лечения определяется индивидуально, как правило до исчезновения симптоматики.
Побочные эффекты, передозировкаПри несоблюдении инструкции могут возникнуть аллергические реакции, ухудшение самочувствия, ожоги. Необходимо четко следовать указаниям врача.
Где купить и сколько стоитТехнический нитрат серебра продаётся заводами-производителями оптом, либо специализированными интернет-магазинами в розницу. Оптовая цена составляет 100 руб/кг, розничная – 1700 рублей за 100 грамм. Медикамент продаётся в аптеках, стоимость порядка 200-300 рублей.
ЗаключениеНитрат серебра – это важное для фармацевтики соединение, получаемое на основе смешивания кислоты и серебром. Раствор нитратов используются как проявитель фото, для получения реактивов. Препараты проявляют бактереостатическую и противомикробную активность. Использовать их нужно осторожно, т.к. активный компонент может отрицательно воздействовать на неповреждённую слизистую.
Читайте также:
Сульфат алюминия: свойства, применение Дихлорметан: свойства, реакции, применение Алюмосиликаты: свойства, виды, получение, применение Оксиды железа: свойства, реакции, применение, польза и вред
Свежие комментарии