Сульфид алюминия – это неорганическое вещество, состоящее из амфотерного металла алюминия и остатка серы. Применяется в основном в химии, оно необходимо для получения металлического алюминия, применимо для создания деталей автомобилей, бытовой техники. Его вносят в состав литиевых батарей. Сульфид алюминия токсичен и отрицательно влияет на здоровье при непосредственном контакте слизистых оболочек с ним и открытых участков кожи, в связи с этим при работе с реагентом необходимо соблюдать меры безопасности.
Что такое сульфид алюминия, формулаСульфид алюминия представляет собой соль, относящаяся к типу бескислородных солей, в которых неметалл находится в низшей валентности. Валентность – это способность атома удерживать около себя другие атомы. Формула сульфида алюминия – Al2S3. Она показывает, что на один алюминий приходится три атома серы.
В природе сульфид алюминия не встречается, это синтетическое соединение, которое синтезируется в лабораторных и промышленных условиях преимущественно для производства продукции путём его обработки.
Физические свойства, внешний видСульфид алюминия — это мелкодисперсный кристаллический порошок белого цвета, иногда с желтоватым, сероватым оттенком. При подогревании данная бескислородная соль окисляется на воздухе. Хорошо растворяется в воде с прохождением полного гидролиза, поэтому водного раствора сульфида алюминия не существует. Даёт кислую реакцию среды за счёт выделения сероводорода. Не растворяется в органических растворителях, в том числе спиртах: метаноле, этаноле, глицерине, не растворим в эфирах и ацетоне. Раствор сульфида алюминия представляет собой взвесь веществ, оставшихся после разложения водой. В растворе протекает реакция полного гидролиза – взаимодействие с водой с превращением компонентов.
Температура плавления составляет 1100°С, разлагается при температурном режиме, достигающем 800°С и активном воздействии кислорода. Возгонка (переход из твёрдого состояния сразу в пар) протекает при нагревании до 1500 °С. Молекулярная масса (отношение массы к его количеству) – 150,158 г/моль. Вещество довольно плотное: 2,02 г/см3.
По структуре кристаллов сульфид алюминия сильно варьирует. Выделяют несколько типов кристаллического строения, которое обозначается буквами греческого алфавита:
бета-форма отличается гексагональной симметрией: имеется 6 углов, образующих правильную призму; альфа-форма гексагональна, однако сульфид алюминия здесь менее плотен; гамма-форма характеризуется ромбоэдрической симметрией, при которой формируется структура, напоминающая параллелепипед, однако три угла из них не являются прямыми; сигма-форма тетрагональна, для неё характерна наивысшая плотность, все углы правильные – 90 °.Возможен синтез сульфида алюминия, в котором алюминия имеет валентность, равную единице. Формула – Al2S. Это редкое и неустойчивое соединение, способное поддерживать стабильность только в условиях высокой температуре и в газообразном состоянии.
Химические свойстваХимические свойства сульфида алюминия схожи со свойствами подобных соединений. Он взаимодействует со щелочью, кислотами, а также другими солями. Для него характерны реакции обмена. Раствор сульфида алюминия в реакционных смесях чаще всего не применяется, поскольку не содержит необходимого реактива (он сразу разлагается на составляющие компоненты). Сульфид алюминия реагирует с кислотами и щелочами, окисляется при воздействии кислорода.
Реакции с сульфидом алюминия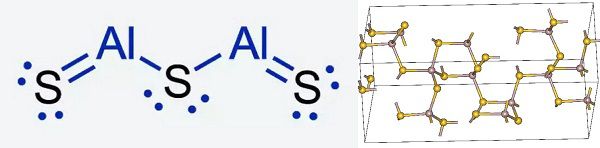
Молекула и структурная формула сульфида алюминия
Вода необратимо гидролизует сульфид до продуктов обмена. В результате раствор сульфида алюминия представлен смесью гидроксида в среде. Реакция даёт нерастворимый осадок гидроксида алюминия и сероводород, уходящий в виде газа:
Al2S3 + 6H2O → 2Al(OH)2↓ + 3H2S↑
Сульфид алюминия реагирует с разбавленной азотной кислотой с выделением оксида азота и сернокислого алюминия:
Al2S3 + 24HNO3 → Al2(SO4)3 + 24NO2 +12H2O
Сульфид алюминия реагирует с кислородом, окисляясь до двуокиси серы и аморфного оксида алюминия:
2Al2S3 + 9O2 → 2Al2O3 + 6SO2
Сульфид алюминия реагирует с соляной кислотой, вступая в реакцию ионного обмена. При этом выделяется хлористый алюминий и побочный продукт в виде сероводорода:
Al2S3 + 6HCl → 2AlCl3 + 3H2S↑
При воздействии на сульфид алюминия концентрированной щёлочи (например, едкого натра), запускается реакция, приводящая к формированию сложного комплексного тетрагидроксоалюмината натрия:
Al2S3 + 8NaOH → 2Na[Al(OH)4] +3Na2S
Сульфид алюминия реагирует с металлической алюминиевой стружкой в вакууме при подогревании:
Al2S3 + 4Al → 2Al2S
Реакция может запуститься в обратную сторону при охлаждении.
Производство и получениеСульфид алюминия в условиях лаборатории можно получить прямым путём из соответствующих элементов:
2Al + 3S → Al2S3
Данный процесс сопровождается выделением большого количества тепла: реакция экзотермична. При этом важно обеспечить в помещении, в котором она проводится, достаточное охлаждение. При наличии источников тепла возможен взрыв и возгорание. Температура поднимется до точки свыше 1000 °С.
Синтез возможен из алюминия и дигидросульфида:
2Al + 3H2S → Al2S3 + 3H2
В промышленности сульфид алюминия получают с помощью первого метода. Добыча вещества ведётся на специализированных заводах в огнеупорных реакторах под строгим пожарным контролем.
ПрименениеОсновная область применения алюминия сульфида лежит в сфере химической промышленности. Он необходим для производства литиевых батарей, настройки суперконденсаторов, наносетчатых структур, необходимых в ультратонкой электронике, что связано со спецификой физико-химических свойств.
Применение алюминия сульфата в химииВ органической и неорганической химии сульфид алюминия — это реактив, незаменимый для протекания различных реакция. Он не имеет каталитической активности, но выступает источником серы и алюминия для сульфата алюминия, сероводорода, а также оксида и комплексных солей. Другая область – вспенивание и преобразование его в прочный материал, который может выдерживать значительные нагрузки. Это качественный сульфидирующий агент для нефтепереработки.
Применение алюминия сульфида в электротехникеСульфид алюминия применяется в качестве активного центра литий-ионных аккумуляторов. Их устанавливают в электромобили и практически всю современную бытовую технику и характеризуются низким самозарядом, высокой отдачей тока, их не нужно обслуживать. Без них не обходятся телефоны, ноутбуки, видеокамеры. Сульфид алюминия используется в таких батареях, поскольку проявляет структурную необратимость реагирования во время циклических процессов загрузки и разгрузки. Кроме того, он обладает высокой плотностью энергии.
Сетчатые образования из сульфида алюминия увеличивают площадь поверхности и улучшает электрическую проводимость. Это обуславливает высокую плотность и ёмкость ионисторов, которые необходимы для тяжёлого общественного и личного транспорта, питаемого от электричества. Сульфид алюминия выступает компонентом покрытия электронных коммунальных счётчиков, лазерных детекторов, фонарей.
Опасность и первая помощьСульфид алюминия относится к 1 классу опасности – взрывоопасное вещество, чрезвычайно токсичное для здоровья. Особую опасность представляет при вдыхании, он оставляет глубокие ожоги на слизистых оболочках дыхательных путей. Это может привести к перфорации и образованию свищей. При попадании в кровь сульфид алюминия накапливается, повреждает нервные окончания, приводит к тяжёлой асфиксии.
Первая помощь при отравлении сульфидом алюминия заключается в немедленном вызове скорой помощи и доставке пострадавшего в больницу. В медицинском учреждении производят срочную очистку кровеносной системы посредством введения лечебных препаратов. Успешность выздоровления зависит от того, насколько быстро будет оказана помощь после отравления.
Чтобы избежать интоксикации, необходимо работать с сульфидом алюминия в защитной одежде: перчатках, респираторе и очках.
Где купить и сколько стоитСульфид алюминия продаётся заводами-производителями оптом. Стоимость 1 кг составляет, как правило, порядка 150 руб/кг. Оптовая закупка от 25 кг. Небольшое количество реактива закупают в интернет-магазинах по цене 15600 руб/кг.
ЗаключениеСульфид алюминия – это кристаллическая белая соль, раствора которого не существует. Он быстро разлагается в воде. Сфера применения алюминия сульфата лежит в области производства реагентов, нефтехимии, электроники. Вдыхание вещества опасно для жизни.
Читайте также:
Хлорид алюминия: свойства, применение Сульфат алюминия: свойства, применение Гидроксид алюминия: свойства, инструкция, применение Алюмосиликаты: свойства, виды, получение, применение
Свежие комментарии